Blog
Por que o sal " derrete " as lesmas ?
10/09/2013 15:47
Porque cloreto de sódio (sal) tem uma propriedade chamada higroscopia, que é uma tendência a atrair água. E como as lesmas não têm o corpo protegido por pele estratificada, contando apenas com uma fina camada unicelular, ela absorve rapidamente a substância, desidratando-se e "derretendo".
"É como quando largamos sal na boca. Ele rapidamente derrete e nós o absorvemos", compara o professor de zoologia José Willibaldo Thomé, da Pontifícia Universidade Católica do Rio Grande do Sul (PUC-RS).
A diferença é que a quantidade de sal que largamos no corpo da lesma é muito maior do que a encontrada no seu organismo, causando o seu "derretimento" através da osmose.
Ou seja, o sal, através da higroscopia, retira toda a água do corpo das lesmas, causando a sua morte.
Por: Pri
Como será que ocorre a explosão do Airbag ?
10/09/2013 15:27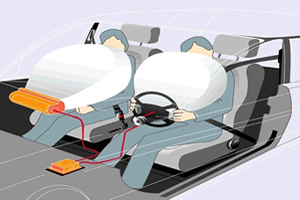
A reação presente no airbag produz gás nitrogênio e silicato alcalino
O airbag é um dispositivo destinado a proteger motoristas e passageiros em caso de colisão. Para haver um perfeito funcionamento, o sistema envolve os seguintes mecanismos:
- sensores localizados na parte frontal do veículo;
- um dispositivo onde há substâncias químicas que reagem entre si quando recebem um impulso elétrico;
- uma bolsa plástica que fica acondicionada dentro do ponto central do volante de direção. No caso do passageiro, a bolsa está localizada no painel logo acima do porta-luvas.
Mas como a bolsa plástica se enche subitamente no caso de uma colisão? E de onde vêm os 70 litros de ar que faz inflar o saco antes da colisão? Na verdade, se trata de um gás que provém de uma reação química de decomposição. Veja como funciona:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no pára-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Alguns centésimos de segundo depois, o airbag está completamente inflado, salvando vidas, veja as equações do processo:
1. NaN3 → 2 Na + 3N2
2. 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
3. K2O + Na2O + SiO2 → silicato alcalino
A reação produz gás nitrogênio e silicato alcalino.
Os airbags complementam a função dos cintos de segurança, agindo conjunta e simultaneamente com o objetivo de reter o movimento dos ocupantes para frente em fortes colisões, eles fornecem uma proteção adicional reduzindo os riscos de ferimentos na cabeça e no tórax.
Por que a cebola provoca lágrimas?
10/09/2013 15:20Você já se fez alguma pergunta do tipo: Por que a cebola provoca lágrimas? A resposta é muito simples, mas você precisa ter um conhecimento químico para responder.

O que faz a gente chorar são os gases que a cebola libera na hora em que alguém passa a faca no vegetal. Em contato com a água dos olhos, eles reagem e formam um ácido que irrita o globo ocular. Aí, para se livrar do incômodo, o organismo contra-ataca, produzindo um rio de lágrimas. Para evitar o aguaceiro, vale cortar as cebolas ao lado de um ventilador, evitando que os gases cheguem perto da visão, ou ainda molhá-las para que o ácido se forme antes de chegar aos olhos. Mas com uma mãozinha da ciência, esse martírio pode acabar. Em outubro de 2002, cientistas japoneses descobriram uma enzima na cebola que estaria envolvida na produção do tal gás irritante. O desafio é produzir um vegetal geneticamente modificado, sem essa enzima.
Fonte: https://www.mundoeducacao.com/quimica/curiosidades-quimicas.htm
Por: Alef
Como funciona o Bafômetro ?
10/09/2013 15:17.jpg)
O bafômetro é um aparelho que permite determinar a concentração de bebida alcoólica analisando o ar exalado dos pulmões de uma pessoa. É também conhecido pela denominação técnica “etilômetro”, devido às reações que envolvem o álcool etílico presente na baforada do suspeito e um reagente.
Todos os tipos de bafômetros são baseados em reações químicas, e os reagentes mais comuns são dicromato de potássio e célula de combustível. A diferença entre estes dois reagentes é que o dicromato muda de cor na presença do álcool enquanto a célula gera uma corrente elétrica.
O mais usado pelos policiais no Brasil é o de Célula de combustível, a química deste bafômetro você vê a seguir:
1. O álcool expirado reage com o oxigênio presente no aparelho, esta reação ocorre com a ajuda de um catalisador;
2. Ocorre a liberação de elétrons, de ácido acético e de íons de hidrogênio;
3. Os elétrons então passam por um fio condutor, gerando corrente elétrica. Um chip presente dentro do aparelho calcula a porcentagem e dá a concentração de álcool no sangue. Quanto mais álcool, maior será a corrente elétrica.
E não existem desculpas para se negar a fazer o teste, como por exemplo:
- Recusar a soprar o canudinho por ele estar contaminado: ele é descartável e tem uma válvula que impede que o ar de dentro volte para sua boca;
- Dizer que não consegue assoprar? É preciso 1 litro e meio de ar para fazer a medição, é o equivalente a um sopro de cinco segundos.
E mais, não adianta tentar disfarçar o hálito, mascar chicletes, tomar azeite, etc, todas essas artimanhas não o impedirão de perder a carteira e ter o veículo apreendido.
Fonte: https://www.brasilescola.com/quimica/como-funciona-bafometro.htm
Por: Pri
Como o Sabão limpa ?
10/09/2013 15:15

Aposto que você já se fez essa pergunta.
Clique no link abaixo e descubra.
Link: https://web.ccead.puc-rio.br/condigital/software/objetos/T2-04/T2-04-sw-a2/Condigital.html
Por: Pri
O Vidro é sólido ou líquido ?
10/09/2013 15:12

Alguma vez você já ouviu essa indagação? É uma dúvida que está perturbando os antigos conhecimentos que tínhamos sobre o vidro, que até então era conhecido como sendo um objeto no estado sólido. Mas qual a verdadeira forma do vidro: sólida ou líquida?
Já sabemos que o vidro é um material inorgânico que possui a sílica como elemento básico. O procedimento de preparo dos vidros consiste em aquecer um líquido até altas temperaturas e depois resfriar este líquido até a temperatura ultrapassar o ponto de congelamento, tornando-o rígido antes que a solidificação tenha início.
Observe que o que ocorre é um supercongelamento desse líquido. Esse fenômeno ocorre por resfriamento brusco a temperaturas muito abaixo do ponto de congelamento. Quando um líquido chega a esse ponto, sua viscosidade torna-se muito alta, adquire maior dureza, rigidez e forma constante, ou seja, ele se torna semelhante aos sólidos.
Para ser sólido o vidro teria que apresentar estrutura cristalina definida, o que não é o caso, pois não possui estrutura microscópica periodicamente organizada. É o que chamamos de sólido amorfo, ou seja, um líquido com viscosidade enorme. Relatos já afirmaram que o vidro escorre se baseando nos vitrais das catedrais antigas, onde existe uma diferença de grossura no topo e na base dos citados vitrais. Mas não existe uma confirmação científica sobre este acontecimento.
O correto é considerar o vidro como sendo um líquido com viscosidade muito elevada, mesmo que isso pareça estranho aos nossos conceitos sobre a individualidade deste material.
Fonte: https://www.brasilescola.com/quimica/o-vidro-solido-ou-liquido.htm
Por: Pri
Chocolateee!!
03/09/2013 22:13
Alguns dos prazeres mais sublimes que temos na vida só existem graças à química. Para o comprovar, hoje falamos do chocolate!
O chocolate atual é o resultado de um longo processo de descobertas, experiências e inovação e durante os próximos minutos, vamos conhecer alguns passos importantes que o tornam tão delicioso!
Talvez não saiba, mas a semente de cacau que é colhida do fruto está muito longe de ter o aroma e o sabor que associamos ao chocolate.
O primeiro processo indispensável para formação das substâncias responsáveis pelo sabor do cacau é a fermentação destas sementes, a qual envolve várias reações químicas.
Mas o que importa reter é que é durante este processo que a proteína de reserva das sementes começa a ser decomposta nos seus aminoácidos constituintes.
O passo seguinte é a torrefação, que permite a evaporação da água e de alguns compostos de cheiro e sabor desagradáveis dos grãos de cacau. Mas a verdadeira maravilha química da torrefação é a cascata de reações que ocorrem entre os aminoácidos formados na fermentação e os açúcares presentes no grão. Estas reações dão origem aos compostos responsáveis pelo aroma e sabor do chocolate (aldeídos, esteres, cetonas, furanos) e formam também os compostos que dão a cor castanha ao grão. O … castanho chocolate!
Antes de podermos desfrutar das delícias do chocolate, falta ainda uma última etapa: a cristalização. O principal responsável pela textura do chocolate, a manteiga de cacau, pode cristalizar de seis formas diferentes, uma propriedade designada por polimorfismo.
O polimorfismo é um arranjo diferente das moléculas para formar o estado sólido, mas desse arranjo resultam diversas propriedades físicas como a cor, o brilho e a temperatura de fusão.
Das seis formas de polimorfismo possíveis para o chocolate só uma tem as características que os consumidores apreciam: apresenta uma superfície sedosa, tem uma textura suave e derrete-se à temperatura da língua.
Infelizmente, esta forma mais saborosa não é a forma mais estável e o último desafio dos fabricantes de chocolate é garantir que todo o chocolate cristaliza na forma correta. Isto só se consegue através de um ciclo de aquecimento e arrefecimento com temperaturas muito controladas.
Se deixar o seu chocolate ao calor, perderá esta forma tão especial e o chocolate vai parecer-lhe sensaborão e difícil de derreter na boca.
Conserve o seu chocolate à temperatura adequada para não desperdiçar os prazeres da química!
Fonte: https://www.aquimicadascoisas.org/?episodio=a-qu%C3%ADmica-do-chocolate
Por: Dani
A bola de futebol
03/09/2013 22:12 
O que torna a bola de futebol mais resistente?
•No ano de 1884, Charles Miller trouxe da Inglaterra a primeira bola a rolar nos campos de futebol brasileiro. A matéria-prima usada era de origem animal, as bolas eram feitas de couro curtido (o famoso capotão) e a câmara de ar era uma bexiga de boi.
•Em 1958, na primeira Copa do Mundo em que o Brasil foi campeão, a bexiga de boi deu lugar à câmara de ar de borracha. Mas em dias chuvosos eis o problema: os campos ficavam cheio de lama e as bolas, ainda feitas de couro, se encharcavam chegando a pesar o dobro do normal.
•Só em 1994, as bolas começaram a ficar mais leves, graças à presença de polímeros. O poliuretano (altamente durável e leve) foi usado como revestimento e nas camadas internas se empregou o poliestireno, as câmaras eram de látex.
•Já na Copa de 2002, mais polímeros fizeram parte da confecção da bola: sob o revestimento de poliuretano se empregou dez camadas de poliestireno e na câmara foi usada a borracha butílica. Outro polímero, o Kevlar, foi usado para costurar a bola.
•Em 2004, os gomos da bola utilizada nas Olimpíadas de Atenas eram unidos por ligações térmicas em vez de costuras.
https://www.brasilescola.com/quimica/bola-futebol-capotao-ao-poliuretano.htm
Carta De Amor De Um Químico
03/09/2013 22:11
Berílio Horizonte, zinco de benzeno de 2000.
Querida Valência:
Não estou sendo precipitado e nem desejo catalisar nenhuma reação irresversível entre nós dois, mas sinto que estrôncio perdidamente apaixonado por você. Sabismuto bem que a amo. De antimônio posso lhe assegurar que não sou nenhum érbio e que trabário muito para levar uma vida estável.
Lembro-me de que tudo começou nurârio passado, com um arsênio de mão, quando atravessávamos uma ponte de hidrogênio. Você estava em um carro prata, com rodas de magnésio. Houve uma atração forte entre nós dois, acertamos os nossos coeficientes, comp
artilhamos nossos elétrons, e a ligação foi inevitável. Inclusive depois, quando lhe telefonei, mesmo tomada de enxofre, você respondeu carinhosamente:
"Proton, com quem tenho o praseodímio de falar?" Nosso namoro é cério, estava índio muito bem, como se morássemos em um palácio de ouro, e nunca causou nehum escândio. Eu brometo que nunca haverá gálio entre nós e até já disse quimicasaria com você.
Espero que você não esteja saturada, pois devemos buscar uma reação de adição e não de substituição. Soube que a Inês lhe contou que eu a embromo: manganês cuidar do seu cobre e acredite níquel que digo, pois saiba qe eu nunca agi de modo estanho. Caso algum dia apronte alguma, eu sugiro que procure um avogrado e que me metais na cadeia.
Sinceramente, não sei por que você está a procura de um processo de separação, como se fóssemos misturas e não substâncias puras! Mesmo sendo um pouco volátil, nosso relacionamento não pode dar errádio. Se isso acontecesse, irídio emboro urânio de raiva.
Espero que você não tenha tido mais contato com o Hélio (que é um nobre!),
nem com o Túlio e nem com os estrangeiros (Germânio, Polônio e Frâncio). Esses casos devem sofrer uma neutralização ou, pelo menos, uma grande diluição. Antes de deitar-me, ainda com o abajur acesio, descalcio meus sapatos e mercúrio no silício da noite,
pensando no nosso amor que está acarbono e sinto-me sódio. Gostaria de deslocar este equilíbrio e fazer com que tudo voltasse à normalidade inicial. Sem você minha vida teria uma densidade desprezível, seria praticamente um vácuo perfeito. Você é a luz que me alumíno e estou triste porque atualmente nosso relacionamento possui pH maior que 7, isto é, está naquela base.
Aproveito para lembrar-lhe de devolver o meu disco da KCl.
Saiba, Valência, que não sais do meu pensamento, em todas as suas camadas.
Abrácidos do:
Leantânio
Fonte: https://www.humornaciencia.com.br/quimica/cartaqui.htm
Por: Dani
O cafezinho
03/09/2013 21:53

O cafezinho
Ela é uma droga poderosa e socialmente aceita, além de ser saborosa; será que a Cafeína é mesmo inofensiva? Possui a propriedade de manter uma pessoa ligada por mais de três horas, sem grandes riscos e sem efeito colateral: mito ou verdade?
A cafeína é um composto químico, conhecido cientificamente por trimetilxantina de fórmula C8H10N4O2, é o principal componente do nosso famoso café. Segundo estudos, essa bebida estimula o sistema nervoso e causa efeitos como: aumento da concentração, atenção e memória.
Os efeitos da cafeína no organismo variam de pessoa para pessoa. Alguns fatores influem no resultado como a idade, o peso e a capacidade do fígado de digerir esta substância. Em média, uma xícara de café já é suficiente para deixar um adulto alerta de 3 a 6 horas.
A explicação fisiológica para este contexto provém do neurotransmissor Adenosina, esta substância produzida no cérebro é a responsável pela sensação de sono, é ela que prepara nosso corpo para o descanso ao final do dia. O que a cafeína faz é impedir a ação da Adenosina e em conseqüência disso aparecem os sintomas de alerta e perda de sono. Resumindo: no cérebro a cafeína é confundida com a Adenosina. A cafeína então ocupa o lugar da Adenosina e reverte todo o processo.
Já que a reação corre no cérebro, a cafeína pode então causar dependência? Ela age como uma droga, apesar de ser leve, mas estudos já comprovaram que pessoas que ingerem café regularmente ficam ansiosos, irritados ou com dor de cabeça se não tomarem sua dose diária. Mas é bom não exagerar na bebida, uma quantidade superior a 500 miligramas de cafeína (o equivalente a 3 xícaras de café expresso forte) podem levar a um processo de intoxicação.
https://www.brasilescola.com/quimica/a-base-cafeina.htm
